Le défi des nitrosamines : le choix des nitrosamines est plus important que jamais

Que sont les nitrosamines ?
Les nitrosamines sont une classe de composés chimiques qui peuvent se former involontairement lors de la fabrication de produits pharmaceutiques. Certaines nitrosamines sont classées comme cancérigènes probables pour l’homme par des organismes de réglementation tels que la FDA et l’EMA. Leur présence dans les médicaments a entraîné des rappels mondiaux de produits médicinaux et un contrôle accru des matières premières, y compris les excipients. Les autorités réglementaires ont identifié des niveaux inacceptables d’impuretés nitrosamines dans divers ingrédients pharmaceutiques actifs (IPA) et autres médicaments approuvés, ce qui a conduit au rappel soudain de médicaments tels que les sartans (incluant valsartan), la ranitidine (Zantac), la nizatidine, la metformine et la varénicline [Bharate SS 2021].
La présence d’amines vulnérables, telles que les amines secondaires et tertiaires, est connue pour accélérer la formation de nitrosamines dans certaines conditions [Ashworth IW 2020]. Ces amines réagissent avec l’acide nitrique dans des conditions acides, entraînant la formation de nitrosamines. L’acide nitrique lui-même est instable et se forme à partir de nitrites (NO2) dans des conditions acides. Parmi les autres sources d’impuretés nitrosamines, on peut citer les matières premières provenant des fournisseurs, les intermédiaires et la réutilisation de solvants, de réactifs, de catalyseurs et de réactifs pendant la synthèse. Par conséquent, lors de la fabrication de produits pharmaceutiques, plusieurs facteurs, tels que le choix des additifs, des conservateurs et des excipients, doivent être soigneusement évalués. En outre, les conditions d’entreposage après la fabrication, telles que la température, l’humidité et le pH du produit, peuvent également créer un environnement propice à la formation d’impuretés nitrosamines. Les formulateurs doivent tenir compte de tous ces facteurs lors du développement de nouveaux produits.
Les impuretés de type nitrosamines sont reconnues comme des impuretés mutagènes de classe 1, susceptibles d’être cancérigènes selon les lignes directrices M7 de l’ICH. Face à ce risque, plusieurs autorités réglementaires telles que l’EMA et la FDA ont publié des recommandations spécifiques et exigé des titulaires d’autorisation de mise sur le marché (MAH) qu’ils réalisent une évaluation approfondie du risque de formation de nitrosamines dans leurs médicaments.
Cette évaluation implique une analyse rigoureuse de toutes les étapes du développement pharmaceutique, ainsi que des matériaux utilisés, tant pendant qu’après le processus de fabrication. Elle commence par l’identification des sources potentielles de formation de nitrosamines, qui comprennent les matières premières et les excipients, les procédés de fabrication, les conditions d’entreposage et la conception des équipements et des installations. L’identification des sources est suivie de la mise en œuvre de stratégies de contrôle appropriées, qui comprennent l’optimisation des processus, la sélection d’excipients à faible risque, les tests et la surveillance à l’aide de méthodes d’analyse appropriées.
Les excipients sont des composants essentiels de la majorité des médicaments et, par conséquent, la sélection d’excipients à faible risque de nitrosamine est un élément crucial de l’évaluation des risques.
Un excipient « à faible risque de nitrosamine » :
- Présente des niveaux d’amines et de nitrites constamment inférieurs aux limites détectables (niveaux ppm en dessous de la norme).
- Est fabriqué dans des conditions contrôlées afin de limiter la contamination.
- Est testé et qualifié à l’aide de méthodes analytiques validées.
- Contient peu de solvants résiduels susceptibles de contribuer à la réaction de nitrosation.
Les limites de nitrite dans les excipients ne sont pas explicitement définies par une norme universelle unique, mais sont plutôt évaluées sur la base d’une analyse des risques, comme décrit ci-dessus, et de lignes directrices établies pour la formation de nitrosamines dans les médicaments. Les fabricants évaluent les niveaux de nitrite dans les excipients dans le cadre d’une stratégie plus large visant à atténuer le risque d’impuretés nitrosamines. Les fabricants d’excipients ne sont pas tenus, mais sont encouragés à tester la teneur en nitrite de leurs excipients et à partager ces données.
Le lactose est l’un des principaux excipients qui entre dans la composition de divers médicaments, compléments alimentaires et produits alimentaires. Dérivé du lactosérum, qui est d’origine naturelle, le lactose présente généralement de faibles teneurs en nitrites. MEGGLE est le premier fabricant de lactose de qualité pharmaceutique et alimentaire, disponible dans l’industrie sous différentes formes et qualités. Reconnu historiquement pour son engagement en faveur de la fabrication de produits de qualité, MEGGLE a non seulement lancé des qualités de lactose à faible teneur en nitrites, mais a également investi massivement dans le développement d’une méthode robuste de chromatographie ionique (CI) permettant de quantifier avec précision les nitrites, avec une limite de quantification (LQ) de 0,03 ppm.
Dans la publication de Boetzel et al. [2022], la teneur en nitrites du lactose provenant de huit fournisseurs variait de 0,07 à 1,7 ppm, avec une moyenne de 0,54 ppm (tableau 1).
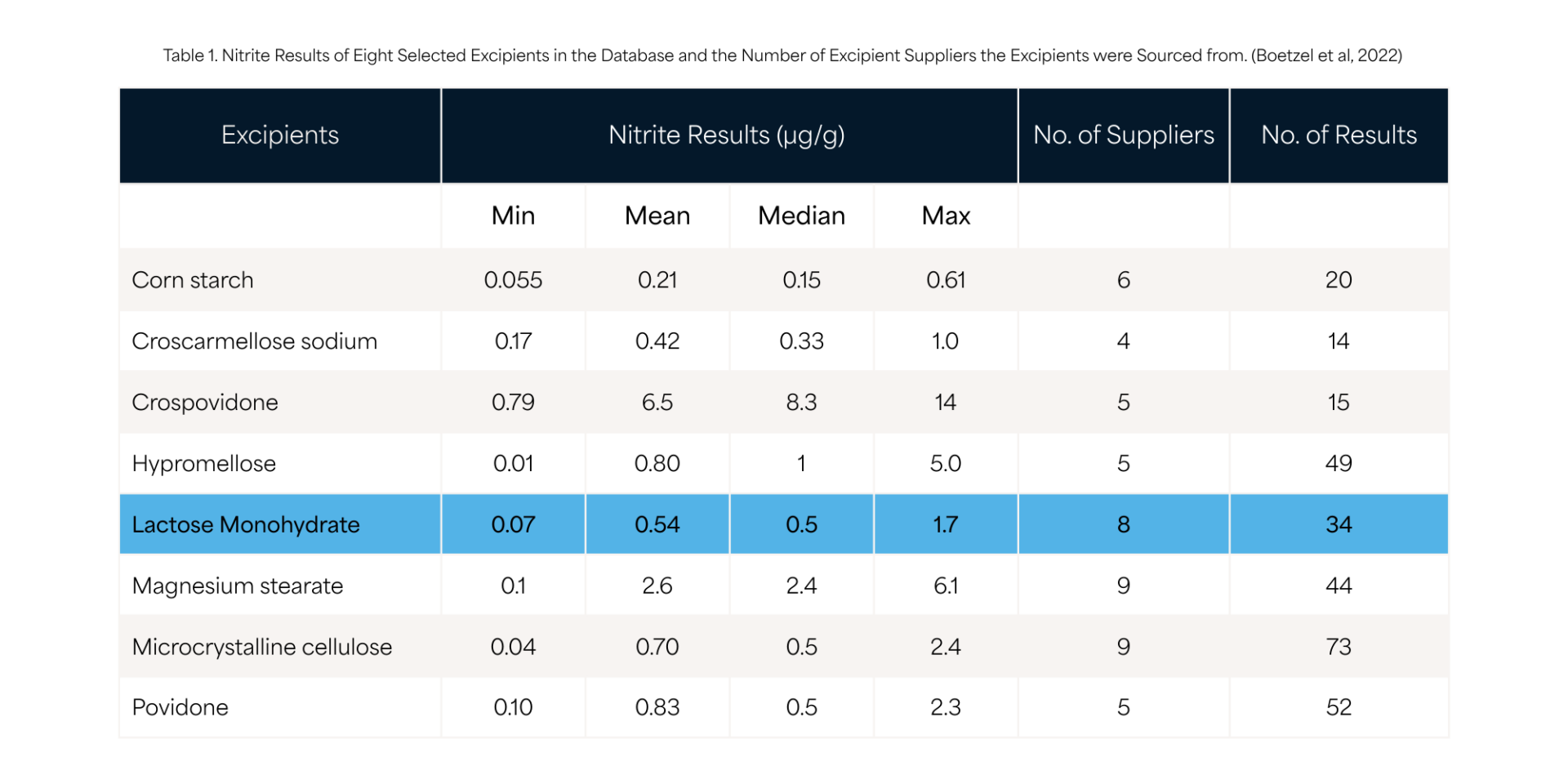
Cependant, comme la contribution du nitrite est considérée comme additive, la somme et la quantité totale de tous les excipients dans la formulation doivent être prises en compte. Les charges/diluant étant généralement utilisés en plus grandes proportions, ils pourraient jouer un rôle important même si leur teneur en nitrite est relativement faible.
La méthode CI de MEGGLE est beaucoup plus sensible que la méthode CI récemment publiée pour le lactose dans la note d’application de l’USP (la limite de quantification en nitrite 0,2 ppm). Grâce à une validation supplémentaire, ils ont démontré qu’elle permettait de fixer en toute sécurité une limite ≤ 0,10 ppm pour les grades de lactose à faible teneur en nitrite.
MEGGLE mesure le paramètre nitrite sur chaque lot. La valeur nitrite fait partie des spécifications du produit et du certificat d’analyse correspondant pour toutes les qualités à faible teneur en nitrite de MEGGLE. Cela simplifie non seulement l’évaluation des risques pour les clients, mais démontre également la conformité aux limites de nitrite définies pour les produits critiques.
MEGGLE a lancé les produits haut de gamme suivants, avec une teneur maximale en nitrites de 0,1 ppm, afin de réduire le risque de formation de nitrosamines dans les produits pharmaceutiques.
- GranuLac® 200 à faible nitrite
- GranuLac® 230 à faible nitrite
- Tablettose® 100 à faible nitrite
- FlowLac® 100 à faible nitrite
Ready to learn more?
Références originales anglaises
Boetzel, R., Schlingemann, J., Hickert, S., Korn, C., Kocks, G., Luck, B., Blom, G., Harrison, M., François, M., Allain, L. R., Wu, Y. & Bousraf, Y. (2023). A Nitrite Excipient Database: A useful Tool to Support N-Nitrosamine Risk Assessments for Drug Products. Journal of Pharmaceutical Sciences. Vol 112 (6) P1615 – 1624.
Ricarda L., RISK MITIGATION OF NITROSAMINES FORMATION IN DRUG PRODUCTS:Role of Excipients. A White Paper by MEGGLE.
Hemanth P.R.V. et al. (2024). Nitrosamines crisis in pharmaceuticals Insights on toxicological implications, root causes and risk assessment: A systematic review. Journal of Pharmaceutical Analysis. Vol 14.
Bharate S.S. (2021). Critical analysis of drug product recalls due to nitrosamineimpurities, J. Med. Chem. Vol 64, P2923 – 2936.
Ashworth I.W., Dirat O., Teasdale A., et al. (2020), Potential for the formation of nitrosamines during the manufacture of active pharmaceutical ingredients: An assessment of the risk posed by trace nitrite in water, Org. Process Res. Dev. Vol 24 P1629 – 1646.




